首页 > 注射用重组人凝血因子VIIa说明书
修改日期:2015年12月7日|2020年1月14日
注射用重组人凝血因子VIIa说明书(丹麦诺和诺德公司 Novo Nordisk A/S)
请仔细阅读说明书并在医师指导下使用
- 【药品名称】
- 通用名称: 注射用重组人凝血因子VIIa
处方药物
【成份】
主要成份:重组人凝血因子 VIIa
重组人凝血因子 VIIa 是通过基因工程技术,利用幼仓鼠肾细胞(BHK 细胞)生产的,其分子量约为 50000 道尔顿。
配制后,1 mL 溶液含 1 mg 重组人凝血因子 VIIa。
配制后溶液 pH 值约 6.0。
其它成份:氯化钠、氯化钙二水合物、甘氨酰替甘氨酸、聚山梨醇酯 80、甘露醇、蛋氨酸、蔗糖、组氨酸、盐酸(pH 值调节剂)、氢氧化钠(pH 值调节剂)和注射用水。
【适应症】
用于下列患者群体出血的治疗,以及外科手术或有创操作出血的防治。
- 凝血因子 VIII 或 IX的抑制物 > 5 个 Bethesda 单位(BU)的先天性血友病患者;
- 预计对注射凝血因子 VIII 或凝血因子 IX,具有高记忆应答的先天性血友病患者;
- 获得性血友病患者;
- 先天性凝血因子 VII(FVII)缺乏症患者;
- 具有血小板膜糖蛋白 IIb-IIIa(GPIIb-IIIa)和/或人白细胞抗原(HLA)抗体和既往或现在对血小板输注无效或不佳的血小板无力症患者。
【规格】
1 mg(50KIU)/支;2 mg(100KIU)/支;5 mg(250KIU)/支
【用法用量】
应在对于血友病和出血性疾病方面有经验的医师监督下开始本品的治疗。
用量
伴有抑制物的血友病 A 或 B 或预期具有高记忆应答的患者
应在出血发作开始后尽早给予本品。静脉推注给药,推荐起始剂量为 90µg/kg 体重。
初次注射本品后可能需再次注射。疗程和注射的间隔将随出血的严重性、所进行的有创操作或外科手术而不同。
用药间隔
最初间隔 2-3 小时,以达到止血效果。如需继续治疗,一旦能够达到有效的止血效果,只要治疗需要,给药间隔可增加至每 4、6、8 或 12 小时给药。
轻度至中度出血发作(包括家庭治疗)
1)90µg/kg 体重,间隔 3 小时给药,2 至 3 次以达到止血效果,如需继续治疗,再给药 1 次 90µg/kg 体重以维持止血作用。
2)1 次注射给药 270µg/kg 体重。家庭治疗疗程不得超过 24 小时。只有咨询过血友病治疗中心后,才可以考虑继续家庭治疗。尚无老年患者中按 270µg/kg 体重的剂量单次注射给药的临床经验。
严重出血发作
建议起始剂量为 90µg/kg 体重,可在患者去医院途中给药。随后的剂量因出血的类型和严重程度而异。最初的用药频率应每隔 2 小时给药 1 次,直到临床情况改善。如果需要继续治疗,可增至每隔 3 小时给药,持续 1-2 天。之后只要治疗需要,可连续增至每隔 4、6、8 或 12 小时给药。对于大出血发作,可能治疗 2-3 周,但如果临床需要,可继续使用本品治疗。
有创操作/外科手术
在治疗之前,应立即给予 90µg/kg 体重的起始剂量。2 小时后重复此剂量,随后根据所进行的有创操作和患者的临床状态,在前 24-48 小时内间隔 2-3 小时给药。在大的外科手术中,应间隔 2-4 小时按该剂量给药,连续 6-7 天。在接下来的 2 周治疗中,用药间隔可增至 6-8 小时。进行大的外科手术的患者可给药到 2-3 周,直至痊愈。
获得性血友病
用量及用药间隔
应在出血发作开始后尽早给予本品。静脉推注给药,推荐起始剂量为 90µg/kg 体重。初次注射本品后可能需再次注射。疗程和注射的间隔将随出血的严重性、所进行的有创操作或外科手术而不同。最初间隔 2-3 小时,以达到止血效果。一旦达到有效的止血效果,只要治疗需要,可增至每隔 4、6、8 或 12 小时给药。
凝血因子 VII 缺乏症
根据国外上市情况,推荐:
用量、剂量范围及用药间隔
治疗出血发作和预防外科手术或有创操作中出血的推荐剂量范围,包括成人及儿童,为 15-30µg/kg 体重,每隔 4-6 小时给药,直至达到止血效果。注射剂量和频率应视个体而定。
血小板无力症
根据国外上市情况,推荐:
用量、剂量范围及用药间隔
治疗出血发作和预防外科手术或有创操作中的出血的推荐剂量为 90µg(范围 80-120µg)/kg 体重,用药间隔为 2 小时(1.5-2.5 小时)。为确保有效地止血,应至少给药 3 次。由于连续滴注可能疗效不佳,因此建议采用推注给药途径。对于非难治性患者,血小板输注是血小板无力症的一线治疗方法。
用法
按照本品使用说明书复溶,在 2-5 分钟内缓慢静脉推注给药。
本品不得与输液混合,也不可以滴注方式给药。
治疗监测--实验室检测
无需对本品的治疗进行监测。应根据出血情况的严重性和注射本品后的临床反应指导用药的需求。注射本品后,凝血酶原时间(PT)和活化的部分凝血活酶时间(aPTT)已显示被缩短,但并未证实 PT 和 aPTT 与本品临床疗效相关。
操作指南
在使用前务必仔细阅读该操作指南
本品为粉末,操作指南在注射前需要用注射器中的溶剂复溶。该溶剂为组氨酸溶液。复溶后的本品将注入静脉中(静脉注射)。包装中的装置是用于本品的复溶和注射。同时还需要输液装置(导管、蝴蝶针头)、无菌酒精棉球、纱布和胶带,而这些不包含在本品包装中。
未经医护人员培训前,请勿使用本品。
每次使用前都洗手以确保自身区域的洁净。
在准备好要使用时才打开本品。
如果产品掉落或者损坏,请不要使用。启用新的产品代替。
如果已经过期,请不某使用。启用新的产品代替。有效期印在外包装盒、药瓶、药瓶适配器和预填充注射器上“有效期”之后。
如果怀疑产品已被污染,请不要使用。启用新的产品代替。
不要丢弃任何元件,直至注射完成。
本装置仅能一次性使用。
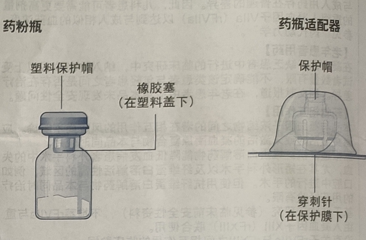
内容物
本品包装中含有:
· 1 个装有重组人凝血因子 VIla 药粉的药瓶
· 1 个药瓶适配器
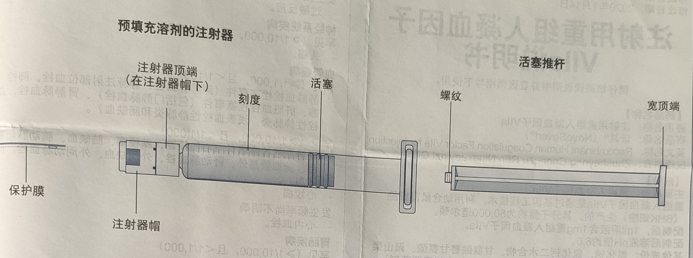
· 1 个装有溶剂的预填充注射器
· 1 个活塞推杆(注射器下方)示意图
1. 药瓶和注射器的准备· 取所需数量的本品。· 检查有效期。· 检查包装上的名称、规格和颜色,确保使用正确的产品。· 洗手并用干净的纸巾擦干或风干。· 将包装中的药瓶、药瓶适配器和预填充注射器取出,活塞推杆留在包装内不动。· 将药品和注射器室温放置(不要超过 37 ℃ ),也可将其握在手中直至与手温相同。· 不要使用其他方式加热药瓶和预填充注射器。
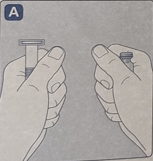
· 将药瓶的塑料保护帽取下。如果塑料保护帽不牢固或者缺失,请勿使用。· 用无菌酒精棉球擦拭橡胶塞,晾干几秒后使用,以保证尽可能无菌。· 不要用手触摸橡胶塞,以免带入细菌。不要丢弃任何元件,直至注射完成后。
2. 连接药瓶适配器· 将药瓶适配器的保护膜撕开。如果保护膜不密封或者破损,请勿使用。不要用手指将药瓶适配器从保护帽中取出。如果触摸到药瓶适配器的穿刺针,可能会带入细菌。
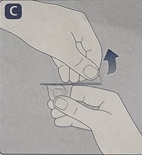
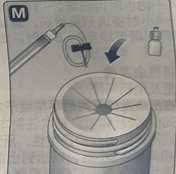
· 将药瓶放置在一个平坦的固体表面。· 翻转保护帽,将药瓶适配器扣在药瓶上。一旦附上,请不要将适配器从药瓶上移开。
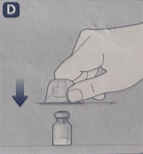
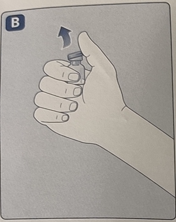
· 如图所示,用拇指和食指轻轻按压保护帽。将保护帽从药瓶上取下。在取下保护帽时,请勿将药瓶适配器从药瓶上抬起。
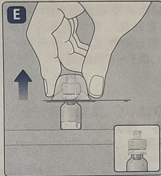
3. 连接活塞推杆和注射器· 握住活塞推杆的宽顶端,从包装中取出。不要触摸到推杆的侧面和螺纹,因为手指可能带入细菌。立即将活塞推杆按照顺时针拧入预填充注射器活塞上,直至遇到阻力。
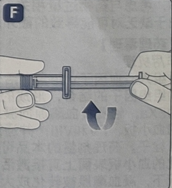
· 往下折断保护帽与射孔连接处,以摘下注射器保护帽。不要触摸注射器保护帽下的注射器顶端,因为手指可能带入细菌。如果注射器保护帽不牢固或缺失,不要使用该预填充注射器。
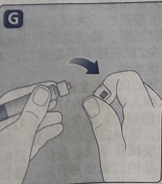
· 将预填充注射器安全地拧在药瓶适配器上,直至遇到阻力。
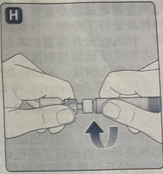
4. 药粉与溶剂的复溶 · 将连着药瓶的预填充注射器微微朝下倾斜。· 推动推杆,将溶剂注入药瓶中。
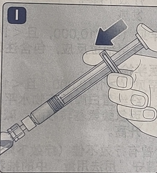
· 持续向下按压推杆,同时缓缓地旋转药瓶,直至药粉溶解。不要振摇药瓶,因为会产生气泡。· 检查复溶溶液。该溶液必须是无色的。如果观察到可见异物或污染物,请勿使用。启用新的包装代替。

为避免感染,本品复溶后请立即使用。如果不能立即使用,参见注意事项。在无医护人员建议下,不要保存复溶溶液。
!如果用量多于 1 瓶,请启用另外的药瓶、药瓶适配器、预填充注射器等重复 A 至 J 步骤直至达到用量。
· 保持推杆完全推注到底。
· 将连着药瓶的注射器倒转,瓶口向下。
· 停止推动推杆,当复溶溶液冲入注射器时,让推杆自动往回移动。
· 轻轻向下拉动推杆,引导复溶溶液至注射器中。
· 遵照医嘱,如果仅需要部分复溶溶液,则按注射器上刻度量取需要量。
· 一旦在注射器的任何位置有空气,将空气推回药瓶中。保持药瓶倒置,轻拍注射器,使气泡上升至顶部。
· 缓缓推动推杆直至气泡全部消失。

· 将适配器与药瓶旋开。
· 不要触摸注射器顶端,因为手指可能会带入细菌。
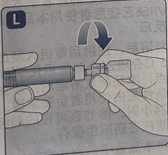
用预填充注射器通过静脉(IV)导管的无针接头注射本品时
注意:预填充注射器由玻璃制成,与标准的 luer 锁紧套口连接兼容。一些带有内部穿刺针的无针接头与该预填充注射器不兼容,这可能导致无法给药或损坏无针接头。
请遵守无针接头的使用说明。通过无针接头给药,可能需要将复溶溶液注入一个标准的 10 mL 无菌 luer 锁塑料注射器中。该操作应在步骤 J 后完成。
5. 注射复溶溶液
现在可将本品注入静脉。
· 遵照医护人员的指导,注射本品。
· 缓慢注射 2-5 分钟。
经中心静脉通路装置(CVAD),如中心静脉导管或皮下输液港,注射本品时:
· 用干净无菌技术操作。遵守使用说明以正确使用接头和 CVAD,同时咨询医护人员。
· 可能需要使用无菌 10 mL 塑料注射器将抽取的复溶溶液注入 CVAD。
· 如果 CVAD 管在本品注射前后需要冲管,使用 9 mg/mL 的注射用氯化钠溶液。
处理
· 注射完后,将连着输液装置的注射器、连着药瓶适配器的药瓶、不再使用的以及其他废弃物,遵照医嘱安全丢弃。
· 不要将其与普通家庭垃圾一起丢弃。
不要在丢弃前拆卸该装置。
不要重复利用该装置。
【禁忌】
对本品中含有的活性成份或任何其他成份,或小鼠、仓鼠或牛蛋白有过敏反应的患者禁用。
【注意事项】
在组织因子表达强度可能高于正常的病理情况下,使用本品有发生血栓事件或导致弥散性血管内凝血(DIC)的潜在风险。
此种情况可能包括晚期动脉粥样硬化疾病、压碎伤、败血症或弥散性血管内凝血患者。由于血栓并发症的风险,有冠心病史患者、肝病患者、术后患者、新生儿及有栓塞或弥散性血管内凝血风险的患者,用药时需要谨慎,应充分评估应用本品治疗的潜在利益及可能发生的并发症。
由于本品可能含有痕量的小鼠 IgG、牛 IgG 和其它残余培养蛋白(仓鼠和牛血清蛋白),因此使用本品治疗的患者存在对这些蛋白过敏的极小的可能性。在这种情况下,应考虑静脉注射抗组胺剂。
如果过敏或过敏样反应发生,需立即停止给药。万一发生休克,应给予标准的医学处理。患者应被提前告知过敏反应的早期征兆。如果出现这种征兆,应建议患者立即停止使用本品并与医生取得联系。
如果未能止血,须到医院就诊。患者/监护者应尽早地告知医生/监护医院关于本品的使用情况。在注射本品前后,应监测凝血因子 VII 缺乏症患者的凝血酶原时间和凝血因子 VII 的凝血活性。如果使用推荐剂量治疗后,凝血因子 VIIa 活性未达到预期水平或出血未得到控制,应怀疑是否产生了抗体并应进行抗体分析。有报道称,FVII 缺乏的患者手术期间使用本品后出现血栓,但凝血因子 VII 缺乏症患者使用本品后形成血栓的风险尚不明确。参见“不良反应”。
复溶后,注射用重组人凝血因子 VIIa 溶液在 25 ℃ 存放 6 小时和 5 ℃ 存放 24 小时显示化学和物理特性是稳定的。从微生物学的观点,本品配成溶液后,应立即使用。否则,该溶液的储存时间及条件应由使用者负责掌握,通常在 2 ℃ -8 ℃ 存放时间也不应超过 24 小时,除非在可控的和经验证的无菌条件下配制。复溶后的溶液应在药瓶里保存。
将本品置于远离儿童的地方。
对驾驶和机械操作能力的影响
尚不明确。
【临床药理】
重组人凝血因子 VIIa 含有活化的 rFVII。止血机制包括 FVIIa 与暴露的组织因子的结合。形成的复合物激活 FIX 转化为 FIXa、FX 转化为 FXa,触发凝血酶原向凝血酶的转化,凝血酶激活了损伤部位的血小板、FV 和 VIII,并通过纤维蛋白原转化为纤维蛋白形成止血栓子。药理剂量的本品可不依赖于组织因子,在损伤部位的活化的血小板表面上直接激活 FX。这使得在不依赖于组织因子的情况下,凝血酶原被转化成大量的凝血酶。
【药理毒理】
遗传毒性
本品的体外人淋巴细胞培养试验和小鼠体内微核试验结果均为阴性。
生殖毒性
本品给药剂量达 3 mg/kg/天,未见对雄性和雌性大鼠交配行为、生育力和窝参数的不良影响。
在大鼠和兔的生殖毒性试验中,本品剂量分别达 6 mg/kg、5 mg/kg 时出现死亡。大鼠在 6 mg/kg 时未见流产,兔在 5 mg/kg 时流产率为 2 窝/25 窝。雌性大鼠在 6 mg/kg 时 25 只中的 23 只成功生产,但是,其中 2 窝在哺乳早期死亡。本品未见致畸作用。
其他毒性
在猴心血管安全药理学试验中评估过量的 rFXIIIA 亚基(585IU/kg,预期人体剂量的 17 倍)与 rFVIIa(1000 μg/kg,预期人体剂量的 11 倍剂量)联合用药,12 只猴中的 1 只在给药后 4 小时死于血栓形成。促凝血的危险因素,包括每只猴 6 根留置导管和麻醉诱导,可能使试验结果复杂化。目前尚不清楚这种死亡率是与一种或两种药品的过量使用有关,还是与它们之间的特定相互作用有关。未进行在推荐的人体剂量下 rFXIII 和本品联合用药的非临床和临床研究。
【药代动力学】
健康人群
分布,消除和线性
采用 FVII 凝结分析,在 35 例健康白种人和日本受试者中进行的一项剂量递增试验中观察了本品的药代动力学特征。受试者按性别和种族进行了分组,分别给予 40µg/kg 体重、80µg/kg 体重、160µg/kg 体重的本品(每组 3 个剂量)和/或安慰剂。药代动力学特征显示与剂量呈比例关系。不同性别和种族之间的药代动力学特征相似。平均稳态分布容积为 130-165 mL/kg,平均清除率为 33.3-37.2 mL/kg•h,平均终末相半衰期为 3.9-6.0 小时。
伴有抑制物的血友病 A 和 B
分布,消除和线性
采用 FVIIa 分析,对非出血状态下的 12 例儿童患者(2-12 岁)和 5 例成年患者进行了药代动力学研究。在儿童中使用 90 和 180µg/kg 体重的研究剂量下存在剂量比例关系,这与之前更低剂量(17.5-70 μg/kg 体重 rFVIIa)的研究结果一致。儿童的平均清除率相对于成人(78:53 mL/kg•h)要高约 50%,然而两组的平均终末相半衰期均为 2.3 小时。相对于成人的 159 mL/kg,儿童的平均稳态分布容积为 196 mL/kg。清除率与年龄有关,因此,年轻患者的清除率增加可能要高于 50%。
凝血因子 VII 缺乏症
分布和消除
从剂量非依赖性参数上看,单剂量给药 15 和 30 μg/kg 体重后的药代动力学显示两种剂量水平之间无任何显著性差异:平台期分布容积(280-290 mL/kg)、半衰期(2.82-3.11 小时)、总的体内清除率(70.8-79.1 mL/kg•h)和平均停留时间(3.75-3.80 小时)。体内平均血浆回收率约为 20%。
血小板无力症
尚未考察本品在血小板无力症患者中的药代动力学,但预期与血友病 A 和 B 患者中的相似。
临床前安全性资料
临床前安全性试验中的所有结果均与本品的药理学作用有关。
在猕猴晚期心血管模型中用 rFVIIa 与 rFXIII 联合治疗,它们的潜在协同作用导致在低于各药物使用浓度的剂量下出现过大的药理作用(血栓形成和死亡)。
【生产企业】
企业名称:丹麦诺和诺德公司 Novo Nordisk A/S
【上市许可持有人】
Novo Nordisk A/S















